《科学》:人为什么会被热死?中国科学家揭秘中暑致死关键机制
在炎热的夏季,我们或多或少都有过中暑的体验。中暑时,我们可能出现头晕乏力、皮肤灼热等症状。通常来说,稍作休息就能恢复。但是,如果出现重度中暑(即热射病),则可能出现系统性炎症反应、循环衰竭、弥散性血管内凝血和多器脏衰竭等症状,面临死亡风险。
在全球变暖的背景下,全球极端高温天气日渐频繁,热射病造成的威胁也在逐渐上升。然而,有一个关键问题却始终没有得到确切的答案:为什么高温会导致人体出现这些涉及多个系统的致命症状?
在一项发表于《科学》的最新研究中,中南大学湘雅三医院吕奔教授团队揭开了热射病致死的关键机制,并为热射病的预防与治疗提供了方向。

在此前的脊椎动物研究中,有科学家发现细胞的程序性死亡受到两种蛋白的调控:混合系激酶区域样蛋白(MLKL),以及在细胞膜上打孔的Gasdermin家族蛋白(例如Gasdermin D)。有趣的是,这两类蛋白分别对应着两类不同的细胞死亡方式:MLKL被激活时可以导致坏死性凋亡(也就是热射病中细胞死亡的方式),这是一种由信号激活的细胞自我破坏过程;而激活Gasdermin D会导致细胞焦亡,这是病原体感染后触发的主要细胞死亡方式。
对于Gasdermin D,此前已有研究发现这种蛋白在感染诱发的脓毒症中起到了关键作用:它的过度激活会导致弥散性血管内凝血与多器脏衰竭。没错,这些症状同样是热射病的典型症状。
这样的联系给了吕奔教授团队启发:对于这两种症状极其相似的危重症,又都涉及到细胞程序性死亡,而Gasdermin D的过度激活引发了脓毒症的症状,那么热射病中类似的症状是否和MLKL有关呢?
MLKL的激活受到了受体相互作用蛋白激酶3(RIPK3)通道调控,因此,研究团队试图通过小鼠实验检验RIPK3通道与MLKL在热射病中的作用。敲除了RIPK3基因后,处于致命高温、高湿度环境中的小鼠几乎不再出现热射病的相关症状;而在敲除了MLKL基因的小鼠中,大多数也都活了下来。这一系列实验说明,热射病中的细胞程序性坏死主要由RIPK3通路,以及RIPK3的磷酸化底物MLKL所调控。
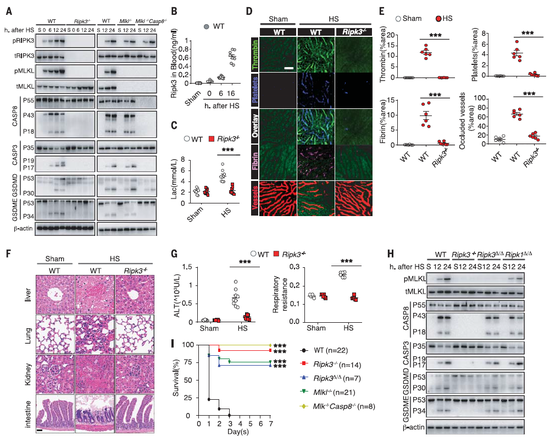
接下来,研究团队顺藤摸瓜,向下一个问题发起了挑战:热应激又是如何影响RIPK3通道的?他们将目标锁定为Z-DNA结合蛋白-1(ZBP1):在小鼠实验中敲除ZBP1基因后,同样能避免热射病的症状。
研究发现,ZBP1的启动子区域中存在热休克因子1(HSF1)的结合位点,因此热应激可以通过HSF1增加ZBP1的表达,并且ZBP1的激活机制与核酸识别无关。随后,ZBP1进一步诱导RIPK3通路激活,最终引发细胞程序性坏死。
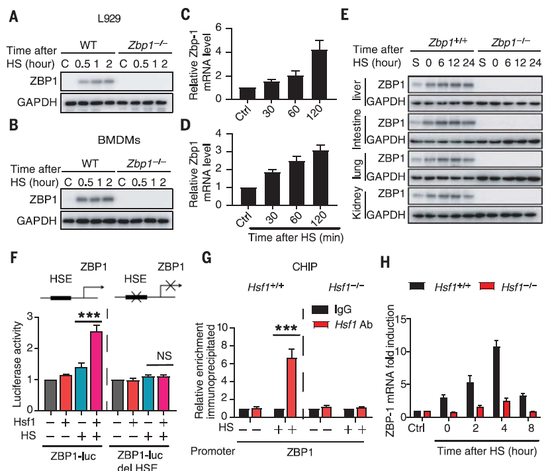
值得一提的是,此前的研究发现了ZBP1在抗病毒感染中的作用,而这项研究揭示了这类蛋白在细胞内的第二种功能:诱导细胞程序性坏死。
当我们将ZBP1的两种功能放在一起,或许就能理解这个机制出现的原因。感染常常导致高烧,过高的体温或能通过激活ZBP1促进病原体被清除、促进炎症反应。然而,持续暴露于环境高温将过度激活这个细胞坏死过程,造成多种致命症状。
这个为了生存而演化而来的机制,却正将更多人置于危险的境地。而当人们逐渐揭开热射病的分子机制,那些高危人群或许能迎来更安全、有效的防治策略。
封面图来源:123RF
参考资料:
[1] Fangfang Yuan et al。, Z-DNA binding protein 1 promotes heatstroke-induced cell death。 Science (2022)。 DOI: 10.1126/science.abg5251
本文来自药明康德内容微信团队
轻薄如纸扬声器问世,将使物体表面成为低功耗高质量音频源
美国麻省理工学院工程师开发了一种纸一样薄的扬声器,可将任何表面变成有源音频源。研究论文日前发表在《IEEE工业电子学会刊》上。这种薄膜扬声器使用传统扬声器所需能量的一小部分,产生失真最小的声音。研究团队演示的手掌大小的扬声器重量约为一枚硬币,无论薄膜黏合到什么表面,都可产生高质量的声音。诺哈网2023-05-25 20:18:230000放任梅毒传染,观察患者如何死去:这项黑暗的实验持续了40年
1953年,PHS的WalterEdmondson医生正从乔治亚州梅肯县Milstead村庄的塔斯基吉梅毒实验被试身上抽取血样。(图片来源:NationalArchives/Publicdomain)塔斯基吉梅毒实验是美国医学研究史上最残忍不堪的一页,被尘封40年的真相虽然早已公布于世,但它带来的教训却依然值得我们回味。作者|JenniferOuellette翻译|彭容诺哈网2023-05-26 19:24:000000预期寿命延长6年多!长寿之国5万人研究发现这8件事很重要
从古至今,人类对健康、长寿的追求从未停止。古时,为追求长寿、长生,秦始皇曾派徐福到蓬莱求仙药;唐太宗曾沉迷丹药;还有很多人钟情于吃玉石。即使在小说中,也有人参果、蟠桃、甚至“唐僧肉”等能让人长生的食物。如今,随着科学的发展,人类对寿命和死亡有了更多了解。尽管还没有完全掌握长寿的秘密,但科学家发现,想要长寿,有一个简单的秘诀——健康的生活方式。诺哈网2023-05-26 21:37:210000害怕被机器人抢工作?教师、律师和物理学家是“最安全的职业”
新浪科技讯北京时间4月16日消息,据国外媒体报道,虽然让机器人取代人类的工作听起来像是科幻电影中的情节,但最新一项研究警告称,未来的职能将发生很大的变化,甚至许多人的工作将真的被机器人替代,面临着下岗危机。诺哈网2023-05-25 20:32:220000苹果公布 WWDC23 日程,主题演讲定档 6 月 6 日凌晨 1 点
IT之家5月24日消息,苹果今日公布了年度全球开发者大会WWDC23的日程,包括主题演讲和PlatformsStateoftheUnion发布时间,并与开发者进一步分享他们即将了解与体验的内容。诺哈网2023-05-26 04:14:340000







